印度Afatinib 40 mg ( xovoltib) GILOTRIF 阿法替尼 吉泰瑞 Giotrif
转移性非小细胞肺癌(NSCLC),转移性鳞状非小细胞肺癌
| 数量: | 库存 60 件 |
药品名/商品名:马来酸阿法替尼(Afatinib)
适应病症: 肺腺癌,非小细胞肺癌
剂型/给药途径:口服
药物类型:靶向治疗药物
上市地区:美国,欧盟,中国大陆,中国香港,中国澳门
中国是否获批:是
适应症:GILOTRIF是壹种激酶抑制剂,适用于: 具有表皮生长因子受体(EGFR)基因19外显子缺失或21外显子(L858R)置换突变的转移性非小细胞肺癌(NSCLC)患者的壹线治疗,以上突变须由FDA批准的检查所检测出。 使用限制:对于其他类型的EGFR突变肿瘤患者,GILOTRIF的安全性和有效性尚未确定。 铂类化疗后疾病出现进展的转移性鳞状非小细胞肺癌患者。
不良反应:腹泻,口腔炎,瘙痒,食欲减退,皮肤干燥,甲沟炎,皮疹/痤疮样皮炎,恶心呕吐
用法用量:推荐剂量:40 mg口服,每天1次
肾功能受损:严重肾功能受损患者,30 mg 口服,每天1次
指导患者在饭前至少1小时或饭后2小时服用GILOTRIF
注意事项:腹泻:腹泻可能导致脱水和肾衰竭。若出现严重腹泻及长期腹泻,且止泻药无效时,停止给药。
大疱性和剥脱性皮肤疾病:临床试验中,有0.2%的患者发生严重的大疱性、水疱性与剥脱性皮肤病变。如果皮肤反应危及生命,需停止给药。皮肤反应严重、持续时,停止给药。
间质性肺病(ILD):有1.6%的患者发生间质性肺病。肺部症状急性发作或恶化时,需暂停给药。对被诊断出患有间质性肺病的患者,停止给药。
肝脏毒性:有0.2%的患者发生致命性肝损伤。患者需定期检查监测肝脏情况,如果肝脏问题严重或恶化,应暂停或终止给药。
角膜炎:有0.7%的患者出现角膜炎。患者需暂停服药,接受角膜炎检查。如确诊为溃疡性角膜炎,应暂停或终止给药。
胚胎-胎儿毒性:孕妇使用,可对胎儿造成伤害。请告知孕妇及有生育能力的女性患者,该药对胎儿有潜在风险,应采取有效避孕措施。
百度百科您身边的百科全书
化学名称:(2E)-N-[4-(3-氯-4-氟苯胺基)-7-{[(3S)-草脲胺-3-基]氧基}喹唑啉-6-基]-4-(二甲氨基)丁-2-烯酰胺
化学结构式:
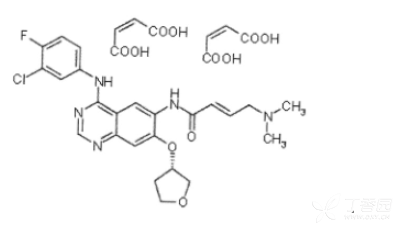
分子式:C24H25CIFN503×2C4H404 或C32H33CIFN5011
分子量: 718.1g/mol(盐形式)
485.9g/mol(游离碱)
本品应在经验丰富的医生指导下使用。开始治疗之前应采用经充分验证的检测方法确定EGFR的突变状态。
推荐剂量
本品的推荐剂量为40mg,每日一次。目前尚无充分证据支持患者可从50mg剂量中得到更大获益。
本品不应与食物同服。在进食后至少3小时或进食前至少1小时服用本品。(见物相互作用和药代动力学)。应整片用水吞服。
本品应持续治疗直至疾病发生进展或患者不能耐受(见下表1)。
因不良反应调整剂量
对于有症状的药物不良反应(如伴有严重/持续腹泻或皮肤相关的不良反应),可根据表1所列,通过中断治疗和减少本品的剂量得到控制。
不良反应(ADRs)的种类一般均与阿法替尼作用机制即对EGFR的抑制相关。最常见的不良反应为腹泻和皮肤相关不良事件,以及口腔炎和甲沟炎。总体而言,降低剂量可使常见不良反应的发生率降低。
对于阿法替尼40mg(每日一次)治疗的患者,因药物不良反应而降低剂量的患者比例LUX-Lung 3 (1200.32)为57%,LUX-Lung 6 (1200.34)为33.1%和LUX-Lung 8 (1200.125)为25%。由于腹泻和皮疹/痤疮不良反应导致停药的患者比例分别为1.3%和0%(LUX-Lung 3), 0%和2.5%(LUX-Lung 6)以及3.8%和2.0%(LUX-Lung 8)。
临床研究中,EGFR突变阳性或突变富集的NSCLC患者人群接受阿法替尼单药治疗的常见ADR(腹泻和皮疹/痤疮)总结于表2。 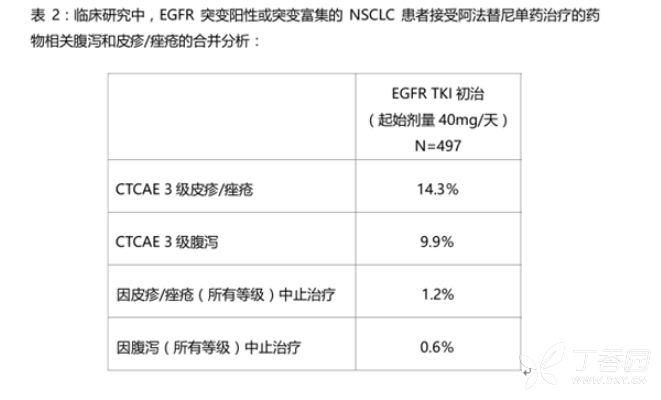
表3对阿法替尼40mg或50mg作为单药治疗在所有NSCLC试验的ADRs发生率进行了总结。下列术语被用于对ADR的发生率进行排序:非常常见≥1/10),常见(≥1/100 至<1/10),不常见(≥1/1,000至<1/100),罕见(≥1/10,000至<1/1,000),非常罕见(<1/10,000)。在每个频率组,不良反应均按照严重程度逐渐降低的顺序列出。
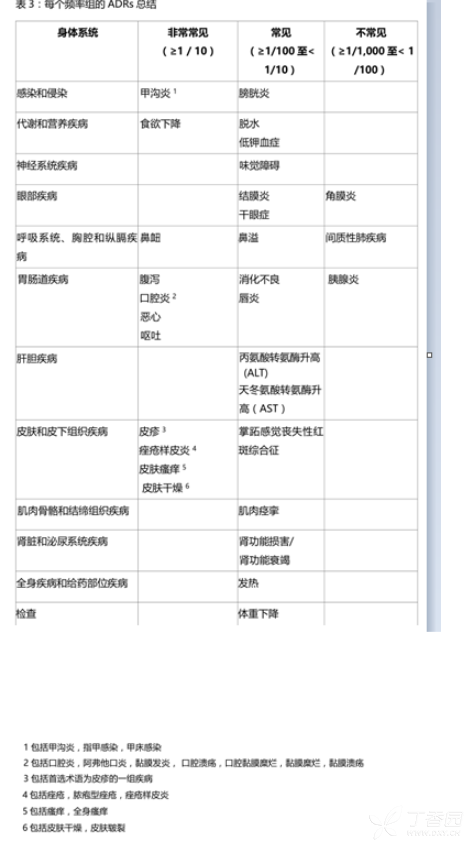
- 评估EGFR基因突变状态
开始治疗前,须选择一个经过良好验证、完善的检测方法,来评估患者EGFR基因突变状态,以避免假阴性或假阳性结果。
- 腹泻
腹泻,包括严重腹泻,在本品治疗期间己有报告。腹泻可导致伴有或不伴有肾功能损害的脱水,在极少的病例中可导致致命结果。腹泻通常在治疗的最初2周内发生。3级腹泻最常发生于治疗的最初6周内。腹泻的主动管理(包括充足的补液结合抗腹泻剂,特别是在治疗的最初6周内)很重要,并且应在最初出现腹泻症状时就开始。应使用抗腹泻剂(如洛哌丁胺),如有必要,应将剂量递增至经批准的最高推荐剂量。患者应随时可获取抗腹泻剂,以便在首次出现腹泻症状时即可开始治疗,并持续到腹泻停止12小时。严重腹泻的患者(持续超过48小时的2级腹泻或3级腹泻)需要中断和减少剂量,或停止本品治疗。脱水的患者可能需要经静脉给予电解质和液体。
- 皮肤相关不良反应
在接受本品治疗的患者中己经报告了皮疹/痤疮。总体上,皮疹都表现为轻度或中度的红斑性和痤疮样皮疹,可在暴露于日光的部位发生或恶化。对于暴露于日光的患者,建议穿防护衣,和/或使用防晒品。对皮肤病反应进行早期干预(如润肤剂、抗生素)有利于持续进行阿法替尼治疗。
伴有持久或严重皮肤反应的患者也可能需要暂时中断治疗、减少剂量、接受额外的治疗干预、以及转诊至具有管理这些皮肤病反应的经验的专家处。己经报道了大疱性、疱性以及剥脱性皮肤病,其中极少病例可能是Stevens-Johnson综合征。如果患者发生严重大疱性、疱性或剥脱性皮肤病,应永久停用阿法替尼治疗。
- 女性、低体重以及潜在的肾功能损害
己经观察到在女性患者、较低体重患者以及有潜在肾功能损害患者中阿法替尼暴露量更高(见【药代动力学】)。这可导致发生EGFR介导的不良事件的风险更高,如腹泻、皮疹/痤疮和口腔炎。建议密切监测具有这些风险因素的患者。
- 间质性肺疾病(ILD)
不同临床试验中接受阿法替尼治疗的4257例患者中,有1.6%发生间质性肺疾病或者 ILD样不良反应(例如,肺浸润、肺炎、急性呼吸窘迫综合征或过敏性肺泡炎),其中0.4%死亡。亚裔患者(2.3%;38/1657)相比白人患者(1.0%;23/2241)的ILD发生率更高。在LUX-Lung 3中,阿法替尼治疗患者中3级或以上ILD的发生率为1.3%,并导致1%死亡。在LUX-Lung 8中,阿法替尼治疗患者中3级或以上ILD的发生率为0.9%,并导致0.8%的死亡。尚未对有ILD病史的患者进行研究。应对出现肺部症状(呼吸困难、咳嗽、发烧)急性发作和/或不可解释恶化的所有患者进行仔细的评估以排除ILD。应中断本品治疗,并对这些症状进行研究。如果确诊ILD,则应永久停用本品,并且必要时采取适当的治疗。
- 严重肝功能损害
己经报道了有少于1%的患者在本品治疗期间发生了肝功能衰竭,包括死亡。在这些患者中,混杂因素包括既存肝病和/或与潜在恶性肿瘤进展相关的合并症。对于预先存在肝病的患者,建议定期检查肝功能。肝功能发生恶化的患者可能需要中断阿法替尼治疗。对于在应用本品期间发生严重肝功能损害的患者,应停用本品。
- 角膜炎
出现急性或恶化的眼部炎症、流泪、光敏感、视力模糊、眼痛和/或红眼等症状应及时转诊至眼科专家。如果诊断证实有溃疡性角膜炎,应中断或停止本品治疗。如果诊断是角膜炎,应仔细考量继续治疗的获益和风险。对于有角膜炎、溃疡性角膜炎或严重干眼症病史的患者,应慎用本品。使用隐形眼镜也是角膜炎和溃疡的风险因素。
- 左心室功能
左心室功能不全与HER2抑制有关。现有的临床试验数据未提示本品会对心脏收缩力造成不良影响。但是,尚未在左室射血分数(LVEF)异常或有严重心脏病史的患者中研究本品。对于有心脏风险因素的患者和具有影响LVEF的条件的患者,应当考虑进行心脏监测(包括在基线时和在阿法替尼治疗期间评估LVEF)。对于在治疗期间发生相关心脏体征/症状的患者,应考虑进行心脏监测(包括LVEF评估)。
对于射血分数低于正常下限的患者,应考虑心脏科会诊及中断或停止阿法替尼治疗。
- P-糖蛋白(P-gp)相互作用
如果在阿法替尼之前给予p-gp强抑制剂,可能会导致阿法替尼暴露量增加,因此应慎用。如果需要使用p-gp抑制剂,应与本品同时给药或在其之后给药。与p-gp强诱导剂同时治疗可能会减少阿法替尼的暴露量。
- 对驾驶和机械操作能力的影响
阿法替尼对驾驶和机器操作能力的影响较小。在治疗期间,部分患者报告的眼部不良反应(结膜炎,干眼症,角膜炎),这可能会影响患者驾驶或操作机械的能力。
P-糖蛋白(P-gp)相互作用
根据体外试验数据,阿法替尼是p-gp的一个底物。根据临床数据,与p-gp抑制剂或诱导剂同时用药可能会改变阿法替尼的暴露量。药物相互作用试验结果证实,只要与本品同时给药或在其后给药,p-gp抑制剂(如利托那韦)可安全地与本品联合使用。如果在本品之前给药,p-gp强抑制剂(包括但不限于利托那韦、环孢霉素A、酮康唑、伊曲康唑、红霉素、维拉帕米、奎尼丁、他克莫司、奈非那韦、沙奎那韦和胺碘酮)可能会增加阿法替尼的暴露量,应慎用(见【用法用量】、【注意事项】和【药代动力学】)。
p-gp强诱导剂(包括但不限于利福平、卡马西平、苯妥因、苯巴比妥或贯叶连翘)可能会减少阿法替尼的暴露量。(见【注意事】和【药代动力学】)。
食物对阿法替尼的影响
本品与高脂餐同服会导致阿法替尼暴露量显著降低,Cmax降低约50%, AUC0-∞降低约39%。本品不应与食物同服(见【用法用量】和【药代动力学】)。
阿法替尼用于EGFR突变的非小细胞肺癌(NSCLC)
LUX-Lung 3 (1200.32)
一项全球性、随机化、多中心、开放试验对EGFR突变阳性的局部晚期或转移性非小细胞肺癌(IIIB或IV期)患者采用阿法替尼一线治疗的有效性和安全性进行评估。
采用基于聚合酶链反应(PCR)的方法(Therascreen®: EGFR29突变试剂盒,Qiagen Manchester Ltd)对患者进行筛查,以确定其是否存在29种不同的EGFR突变。患者按 2:1比例随机接受阿法替尼40mg(每日一次)或培美曲塞/顺铂(最多6个疗程)。在这些随机化患者中,65%为女性,中位年龄为61岁,基线ECOG体能状态评分为0(39%)或1(61%),26%为白人,72%为亚洲人。89%患者有常见EGFR突变(De119或L858R)。
主要终点为基于独立审查确定的无进展生存期(PFS)。次要终点包括总生存期(OS)和客观缓解率(ORR)。2013年11月14日进行的分析中,176名(76.5%)阿法替尼组患者和70名(60.9%)化疗组患者出现一次导致PFS分析的事件,即集中独立审查确定的疾病进展或死亡。
LUX-Lung 6 (1200.34)
一项随机化、多中心、开放试验对EGFR突变阳性的局部晚期或转移性(IIIB/IV期)。
肺腺癌的亚洲患者使用阿法替尼治疗的有效性和安全性进行评估。与LUX-Lung 3相似,采用Therascreen®对未经治疗NSCLC患者的EGFR突变情况进行筛查:EGFR29突变试剂盒(Qiagen Manchester Ltd)。随机化患者中,65%为女性,中位年龄为58岁,所有患者为业洲人,包括中国患者327例(占总人群89.8%)。常见EGFR突变患者占试验人群的89%。
主要终点为集中独立审查的PFS,次要终点包括OS和ORR。
两项试验证实,与化疗相比,阿法替尼治疗显著改善EGFR突变阳性患者的PFS。有效性结果总结见图1 (LUX-Lung 3),图2 (LUX-Lung 6),表4和表5 (LUX-Lung 3和6)。表5展示了两种常见EGFR突变(De119和L858R)患者的亚组结果。
图1:试验LUX-Lung 3(整体人群)按治疗组分的PFS Kaplan-Meier曲线(独立审查) 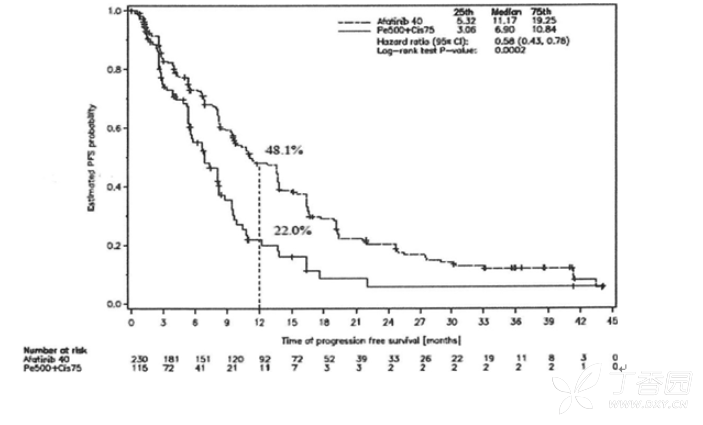
图2: 试验LUX-Lung 6(整体人群)按治疗组分的PFS Kaplan-Meier曲线(独立审查) 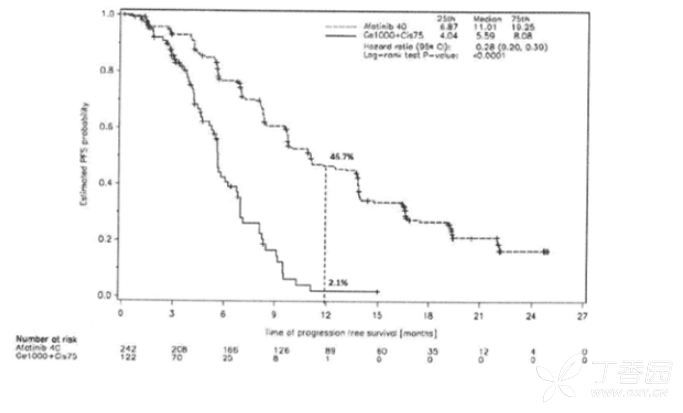
表4:试验中阿法替尼对比培美曲/顺铂(LUX-Lung 3)或吉西他滨/顺铂(LUX-Lung 6) 的有效性结果(独立审查)
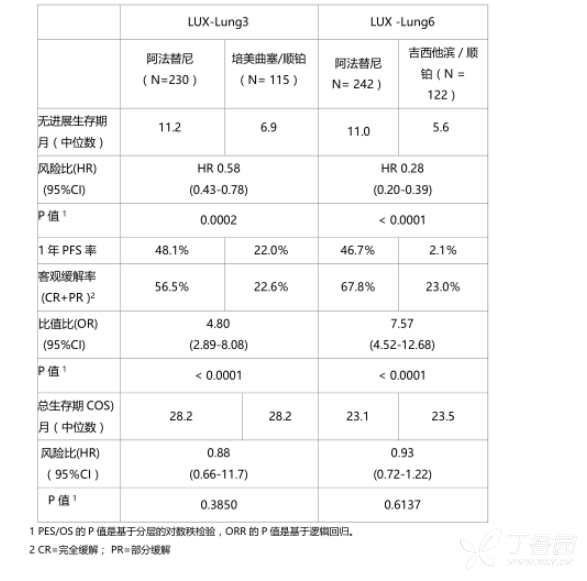
表5:事先定义EGFR De119和L858R突变业组中阿法替尼对比培美曲寨/顺铂(LUX-Lung 3)或吉西他滨/顺铂(LUX-Lung 6)的PFS和OS的有效性结果(独立审查)

针对事先定义阿法替尼组和化疗组常见基因突变(De119, L858R)的亚组分析显小, LUX-Lung 3的中位PFS为13.6个月对比6.9个月(HR为0.48,95%CI为0.35-0.66,P<0.0001;N=307),LUX-Lung 6的中位PFS为11.0个月对比5.6个月(HR为0.24,95%Cl 为0.17-0.35,P<0.0001;N=324)。
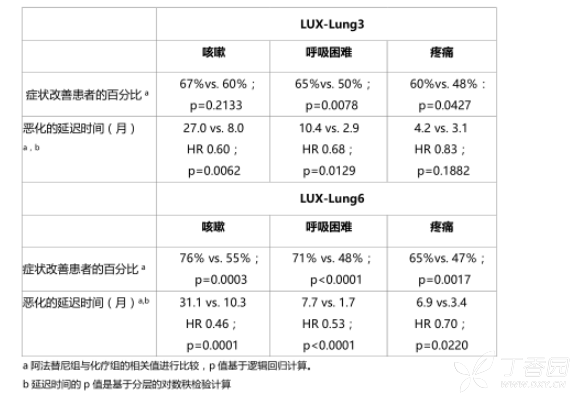
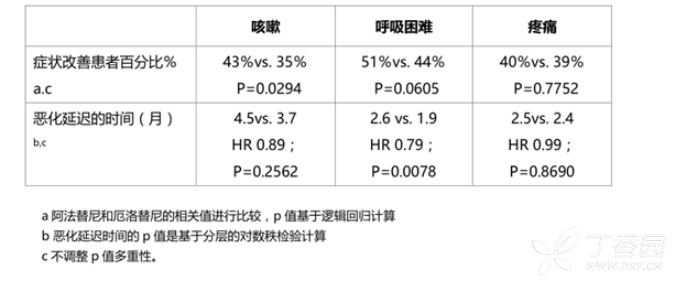
通常情况下,PFS获益伴随着疾病相关症状的改善以及恶化时间延迟(请参见表6)。阿法替尼组患者的整体生活质量平均评分,总体健康状况以及身体、角色、认知、社交和情绪功能均有显著好转。
表6:试验LUX-Lung 3和LUX-Lung 6中阿法替尼组与化疗组的症状性结果(EORTC QLQ-C30和QLQ-LC13)
LUX-Lung 2 (1200.22)
LUX-Lung 2是一项单臂、II期试验,对129例EGFR TKI初治的IIIB或IV期肺腺癌并伴有EGFR突变的患者进行研究。患者分别接受一线治疗(N=61)或二线治疗(N=68)(即既往一种化疗方案失败之后)。接受一线治疗的61例患者中,根据独立审查评价,证实ORR是65.6%,DCR是86.9%。独立审查评价的中位PFS是12.0个月,既往接受化疗的患者的有效率也同样高(N=68;ORR57.4%;独立审查评价的PFS是8 个月)。 一线和二线治疗的中位OS分别为31.7个月和23.6个月。
阿法替尼用于少见突变汇总分析
一项合并临床试验LUX-Lung 2, LUX-Lung 3和LUX-Lung 6的析因分析显示,阿法替尼在携带少见EGFR突变亚型G719X,L861Q和S768I的NSCLC中有效性较高。针对这些突变患者,阿法替尼可以作为明确的治疗选择。相比较而,阿法替尼对原发 T790M突变和20外显子插入突变的有效率较低。
三项临床试验中阿法替尼治疗患者共有600例,其中75例存在少见EGFR突变。该研究将少见突变亚型分为三组:18-21外显子点突变和复制(组1,38例);原发 T790M单独突变或合并其他突变(组2,14例);20外显子插入突变(组3,23例)。其中组1有27例(71.1%,95%Cl 54.1-84.6),组2有2例(14.3%,1.8-42.8),组3有2例(8.7%,1.1-28.0)达到完全缓解。中位PFS分别为10.7, 2.9和2.7个月。中位OS为19.4,14.9和9.2个月。在发生率较高的少见突变亚型中,G719X突变有14例(77.8%,95%CI 52.4-93.6),L861Q突变9例(56.3%,29.9-80.2)和S768I突变8例(100.0%,0%,63.1-100.0)患者达到完全缓解。
阿法替尼用于组织学类型为鳞癌的NSCLC患者
LUX-Lung 8 (1200.125)
在一项全球性,随机化,开放的III期临床试验LUX-Lung 8中 ,评价了阿法替尼作为二线治疗用于晚期鳞状组织学类型NSCLC患者的有效性和安全性。患者在接受至少 4个周期的铂类药物为基础的一线化疗后,按照1:1随机化分配入组,分别接受每日阿法替尼40mg或厄洛替尼150mg治疗,直至疾病进展。根据种族分层(东亚vs 非东亚)进行随机化。主要终点指标为PFS;关键次要终点为OS,其他次要终点包括ORR, DCR, 肿瘤大小变化和HRQOL,共795个患者进入随机,包括中国人75例(阿法替尼组42例/厄洛替尼组33例),多数为男性(84%),白种人(73%),现时吸烟者或既往吸烟者(95%),基线体能状态ECOG 1(67%)和ECOG 0(33%)。
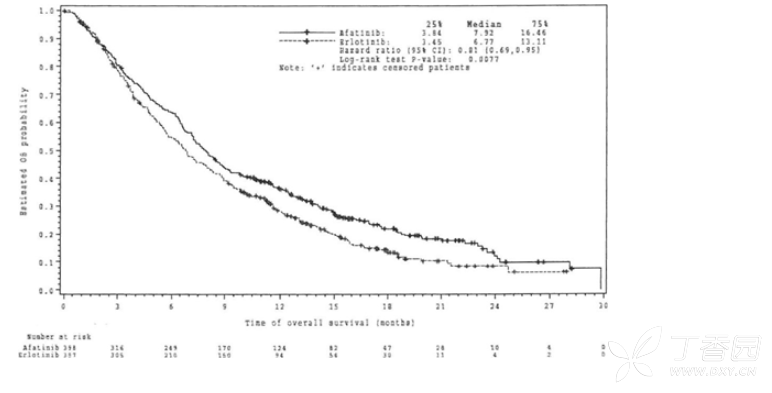
与厄洛替尼相比,阿法替尼二线治疗可显著改善鳞状NSCLC患者的PFS和OS, 包括所有随机患者的OS主要分析时的有效性结果见图3和表7
表7 LUX-Lung 8中阿法替尼对比厄洛替尼的有效性结果,基于OS主要分析,包括所有随机化患者

年龄<65岁患者总生存的风险比为0.68(95% CI0.55,0.85),年龄为65岁及以上患者的风险比为0.95(95% CI 0.76,1.19)。
图3 LUX-Lung 8试验按治疗组分的OS Kaplan-Meier 曲线:
PFS的获益伴随疾病症状的改善和恶化的延迟时间(见表8) 表8:LUX-Lung 8中阿法替尼对比厄洛替尼的症状结果(EORTC QLQ-C30&QLQ -LC13)
重复给药毒性试验:在经口重复给药毒性试验(大鼠给药达26周,小型猪给药达 52周)中,主要毒性靶器官为皮肤(大鼠真皮变化、上皮萎缩以及毛囊炎)、胃肠道(大鼠和小型猪腹泻、胃糜烂、上皮萎缩)和肾脏(大鼠肾乳头坏死)。上述变化可发生在临床治疗相关暴露量之下、范围内或之上。在两个动物种属中均可见多器官发生药理作用介导的上皮萎缩。
遗传毒性:阿法替尼在Ames试验中有1个细菌实验株中出现了反应范围上限的阳性反应;阿法替尼在非细胞毒性浓度下的体外染色体畸变试验、体内骨髓微核试验、体内彗星试验以及MutaTM小鼠经口给药4周的致突变试验中结果均为阴性。
生殖毒性:在一项生育力试验中,雌雄大鼠每日经口给予阿法替尼4、6或8mg/kg。雄性大鼠在6mg/kg(约为推荐人用剂量每日40mg时的AUC水平)或更高剂量下,精子数减少或无精子的发生率升高,但总体生育力未见影响;一般毒理试验可见睾丸细胞凋亡以及精囊和前列腺萎缩发生率增高,支持上述精子计数降低的结果。8mg/kg(约为推荐人用剂量每日40mg时AUC的0.63倍)剂量组雌性动物的黄体数轻度升高,并伴有因早期吸收而着床后丢失的轻度升高。在一项重复给药4周毒性试验中,各给药组雌性大鼠卵巢重量降低,2周恢复期结束尚未完全恢复。
兔胚胎-胎仔发育毒性试验中,妊娠兔给予阿法替尼5mg/kg(约为推荐人用剂量每日40mg时AUC的0.2倍)或更高剂量,可见着床后丢失增加,出现母体毒性的动物中可见妊娠晚期流产。给药剂量为10mg/kg(约为推荐人用剂量每日40mg时AUC的0.7 倍)时,可见胎仔体重减轻,胎仔短小、内脏和皮肤变异的发生率增加。大鼠胚胎•胎仔发育毒性试验中,16mg/kg剂量(约为推荐人用剂量每日40mg时AUC的2倍)可见骨骼变异(包括骨化不完全或骨化延迟)和胎仔体重减轻。
大鼠放射性研究结果显示,阿法替尼可进入乳汁,药后1h和6h时,乳汁中的平均浓度大约是相应血浆浓度的80倍和150倍。
致癌性:尚未进行致癌性试验。
光毒性:体外光毒性检测提示阿法替尼具有光毒性。