印度Exemestane 25mg XTANE 25mg 依西美坦 依西美坦片 阿诺新 速莱 可怡 Natco
浸润性乳腺癌
| 数量: | 库存 100 件 |
通用名:Exemestane 25mg
商品名:XTANE
剂量:25mg 壹盒30片
生产厂商:Natco
适用症:
依西美坦(Xtane)片有助于降低绝经后妇女的雌激素水平,作为回报,它能减缓乳腺肿瘤的生长。
治疗早期和晚期乳腺癌患者的推荐剂量为25 mg,每日壹次,每次壹片,建议餐后服用。
百度百科您身边的百科全书
化学名称:1, 4-二烯-3,17-二酮-6-甲基雄烷
化学结构式:
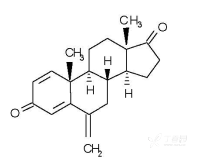
分子式:C20H24O2
分子量:296.41
用于经他莫昔芬辅助治疗2-3年后,绝经后雌激素受体阳性的妇女的早期浸润性乳腺癌的辅助治疗,直至完成总共5年的辅助内分泌治疗。
用于经他莫昔芬治疗后,其病情仍有进展的自然或人工绝经后妇女的晚期乳腺癌。
尚不明确本品在雌激素受体阴性患者中的疗效。
成人和老年患者:
治疗早期和晚期乳腺癌患者的推荐剂量为25 mg,每日一次,每次一片,建议餐后服用。
早期乳腺癌患者在接受2-3年的他莫昔芬治疗后,在未出现复发或对侧乳腺癌的情况下,应使用本品继续治疗,直至完成5年的联合序贯辅助内分泌治疗(即他莫昔芬序贯依西美坦)。
晚期乳腺癌患者应持续服用本品直至肿瘤进展。
合并使用细胞色素P-450(CYP) 3A4的强诱导剂会降低依西美坦暴露量。患者同时接受CYP 3A4强诱导剂,如利福平、苯妥英时,本品的推荐剂量为50 mg,每日一次,餐后服用(见【药物相互作用】和【药代动力学】)。
在接受他莫昔芬序贯依西美坦辅助治疗的早期乳腺癌患者中,7.4%的患者因不良事件退出治疗。最常报告的不良反应为轻度至中度潮热(22%)、关节痛(18%)、疲劳(16%)、头痛(13.1%)、失眠(12.4%)和出汗增多(11.8%)。
由于不良事件而停药在依西美坦组和他莫昔芬组相似(6.3% vs 5.1%)。心肌缺血事件的发生率(心肌梗死、心绞痛、心肌缺血)依西美坦组1.6%,他莫昔芬组0.6%。心脏衰竭的发病率:依西美坦组为0.4%,他莫昔芬组为0.3%。
在所有晚期乳腺癌的患者中,因不良事件而退出研究的比例是2.8%。最常报告的不良反应为潮热(14%)、恶心(12%)、疲乏(8%)、出汗增多(4%)和食欲增加(3%)。
多数不良反应是由于雌激素生成被阻断后而产生的正常药理学反应(如潮热)。
根据发生的频率和系统器官类别将报告的不良反应列出如下(见表1):
发生频率定义为:很常见(1/10),常见(≥1/100至<1/10),少见(≥1/1,000至<1/100),罕见(≥1/10,000至<1/1,000)。
表1.按发生的频率和系统器官分类的不良反应


临床试验经验
因为临床试验是在广泛不同条件下进行的,在一种药物临床试验中观察到的不良反应率不能与另一种药物临床试验中观察到的不良反应率直接比较,并且可能无法反映临床实践中观察到的比例。
血液和淋巴系统异常
依西美坦治疗晚期乳腺癌患者罕见有血小板减少或白细胞减少的报告。约有20%的患者接受本品后出现偶发的淋巴细胞减少,特别是既往有淋巴细胞减少症的患者;但这些患者的淋巴细胞平均计数并未随时间延长发生显著变化,也没有观察到相应病毒感染的增加。在早期乳腺癌研究中未发现以上异常。
早期乳腺癌辅助治疗
下面描述的数据反映了2325名绝经后早期乳腺癌妇女暴露于依西美坦。2项严格对照研究对依西美坦在绝经后早期乳腺癌妇女中的耐受性进行了评价,该2项临床研究分别为IES研究(IntergroupExemestane Study)(见【临床试验】)和027研究(特别设计的随机、安慰剂对照、双盲、平行研究以评价依西美坦治疗2年以上对骨代谢、激素、脂质和凝血因子影响)。
基于试验药物己知的药效作用特点和副作用特征,某些不良反应通过阳性列表(positive checklist)主动搜索。2项研究的症状和体征严重程度均根据CTC(Common Toxicity Criteria)的标准分级。
IES研究中,一些疾病/状况的监测通过阳性列表评估而没有对其严重程度进行评价。这些包括心肌梗死、其它心血管疾病、妇产科疾病、骨质疏松症、骨质疏松性骨折、其它原发性肿瘤和住院治疗。
在IES研究中患者接受辅助治疗的中位治疗时间分别为依西美坦组27.4个月,他莫昔芬组27.3个月。
027研究中接受辅助治疗的中位治疗时间依西美坦组和安慰剂组均为23.9个月。IES研究的中位观察持续时间为依西美坦组34.5个月,他莫昔芬组34.6个月。027研究的中位观察持续时间均为30个月。
在IES研究中,患者因为不良反应而中断治疗的发生率依西美坦组为6.3%,他莫昔芬组为5.1%。
027研究中,患者因为不良反应而中断治疗的发生率本品为12.3%,安慰剂组为4.1%。在IES研究中,依西美坦组患者出现任何原因的死亡发生率为1.3%,而他莫昔芬组的患者为1.4%。由于中风死亡的患者依西美坦组有6例,他莫昔芬组有2例。由于心衰死亡的患者依西美坦组有5例,他莫昔芬组有2例。
心脏缺血事件的发生率(心肌梗死、心绞痛和心肌缺血)依西美坦组为1.6%,他莫昔芬组为0.6%。
心衰的发生率依西美坦组为0.4%,他莫昔芬组为0.3%。
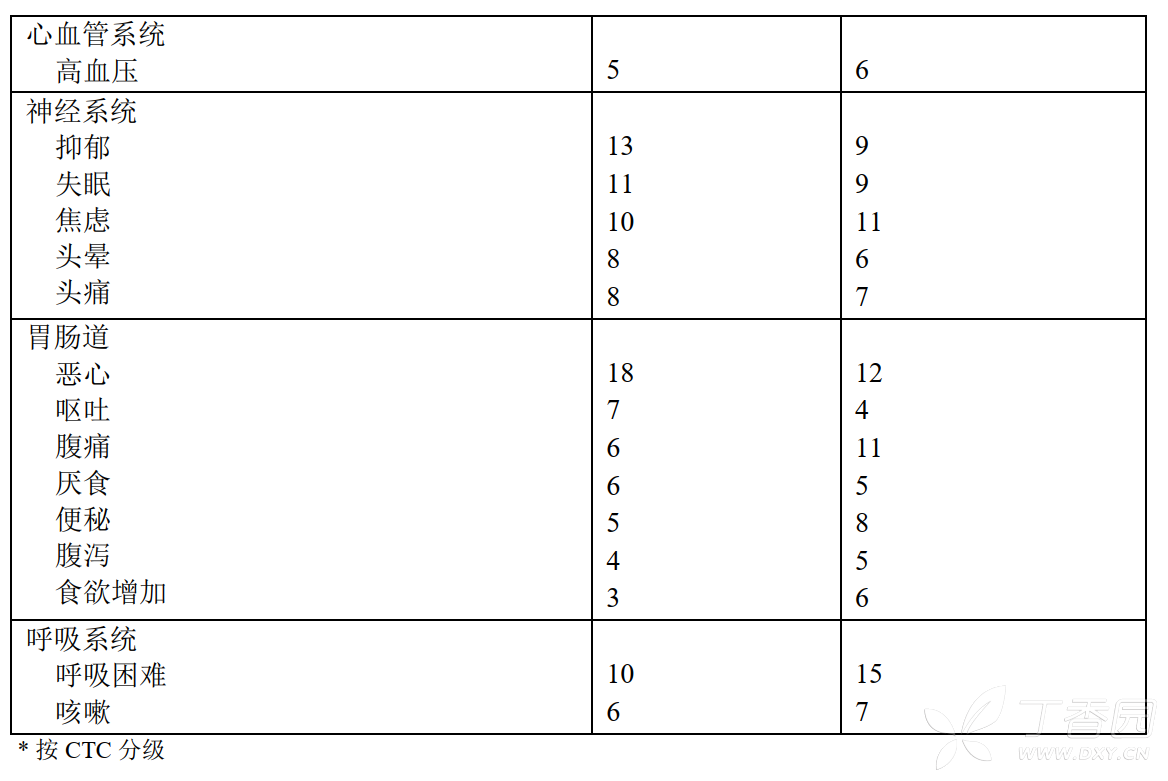
IES研究中在治疗期间和治疗结束后1个月内,患者治疗后出现的各种原因引起的发生率≥5%的不良反应和疾病见表2。
表2.绝经后早期乳腺癌妇女IES研究中所有CTC分级1的不良反应和疾病的发生率(发生率≥5%)
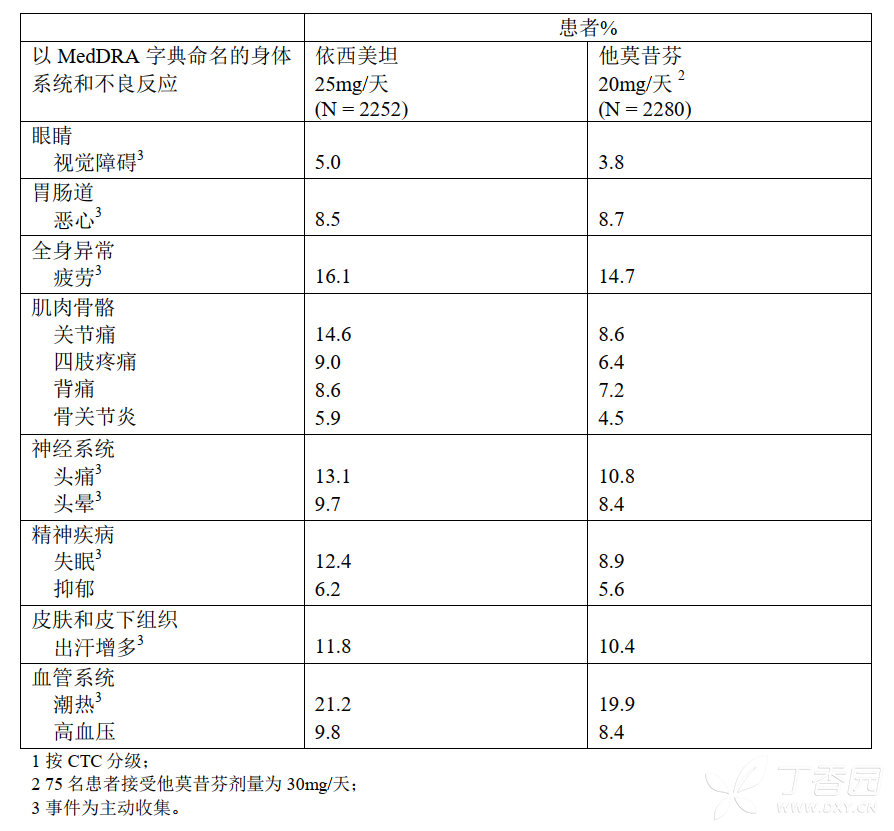
在IES研究中,与他莫昔芬组相比,依西美坦组在肌肉骨骼系统和神经系统的不良事件发生率较高,包括以下发生率低于5%的事件[骨质疏松症(4.6% vs 2.8%)、骨软骨病和扳机指(0.3% vs0)、感觉异常(2.6%vs 0.9%)、腕管综合症(2.4%vs0.2%)和神经疾病(0.6%vs 0.1%)]。
腹泻在依西美坦组发生更频繁(4.2% vs2.2%)。在依西美坦组中有94例(4.2%)患者发生临床骨折,他莫昔芬组中有71例(3.1%)。中位治疗持续时间约30个月和中位随访时间约52个月后,依西美坦组胃溃疡的发生率比他莫昔芬组稍高(0.7%vs<0.1%)。依西美坦组中出现胃溃疡的大部分患者在研究期间同时接受过非甾体类抗炎药物治疗和/或既往有胃溃疡病史。
与他莫昔芬相关的具有较高发生率的不良反应有肌肉痉挛(3.1%vs1.5%)、血栓栓塞(2.0%vs0.9%)、子宫内膜增生(1.7% vs 0.6%)和子宫息肉(2.4% vs0.4%)。
在IES研究中,依西美坦组和他莫昔芬组缺血性心血管事件发生率分别为4.5%与4.2%。对于任何一个单独的心血管事件,两组间未发现有显著性差异,包括高血压(9.9%vs8.4%)、心肌梗死(0.6%vs0.2%)和心衰(1.1%vs0.7%)。
在IES研究中,与三苯氧胺相比,依西美坦与高胆固醇血症的发生率较高有关,依西美坦组与三苯氧胺组发生率分别为3.7%和2.1%。
027研究中常见的不良反应见表3

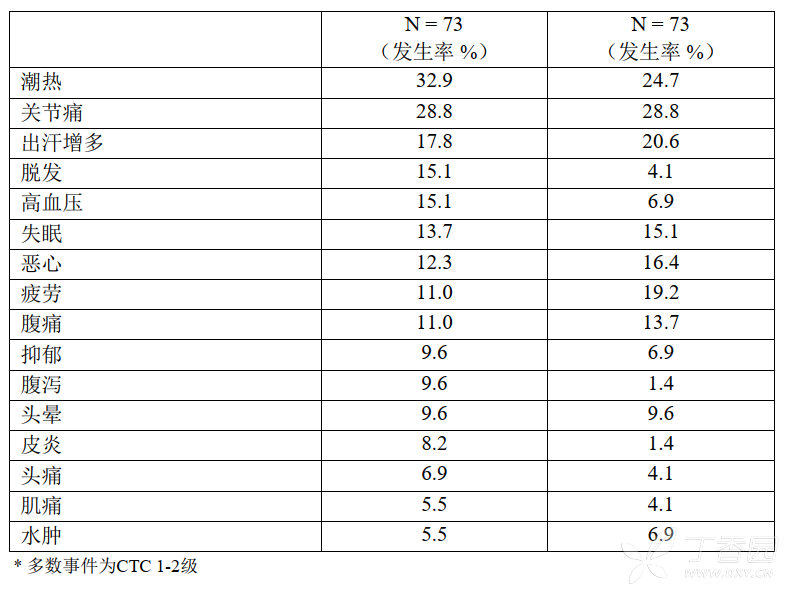
在027研究中依西美坦与血浆HDL-胆固醇平均7-9%的降低相关,而安慰剂组则增高1%。载脂蛋,白A1在依西美坦组降低5-6%,但在安慰剂组降低为0-2%。两组中,其他血脂指标的分析结果(总胆固醇、LDL胆固醇、甘油三脂、载脂蛋白B、脂蛋白-a)相似。这些结果的临床意义尚不清楚。
晚期乳腺癌的治疗
在临床研究中,共有1058名患者接受依西美坦25mg/天的治疗。仅有1例患者的死亡可能与接受依西美坦治疗有关。一例患有冠心病的80岁女性患者在接受依西美坦治疗后第9周出现心肌梗死伴随多脏器功能衰竭。在上述临床研究中,仅有3%的患者因为不良反应而停止治疗,主要发生在治疗的前10周,之后因为不良反应而停止治疗的很少见(0.3%)。
在一项对照研究中,对358名接受依西美坦治疗的患者和400名接受醋酸甲地孕酮治疗的患者进行了不良反应评价。接受依西美坦治疗的患者因为不良反应而停止治疗的发生率低于醋酸甲地孕酮组,分别为2%和5%。与药物有关或不能确定原因的不良反应中依西美坦组和醋酸甲地孕酮组的发生率分别为:潮热(13% vs 5%)、恶心(9% vs 5%)、疲劳(8% vs 10%)、出汗增多(4% vs 8%)和食欲增加(3 vs 6%)。醋酸甲地孕酮组中患者体重增加(>10%基线体重)的比例显著高于依西美坦组,分别为17%和8%。表4显示研究中接受依西美坦或醋酸甲地孕酮治疗的患者的所有CTC分级,无论因果关系,且发生率≥5%的不良反应。
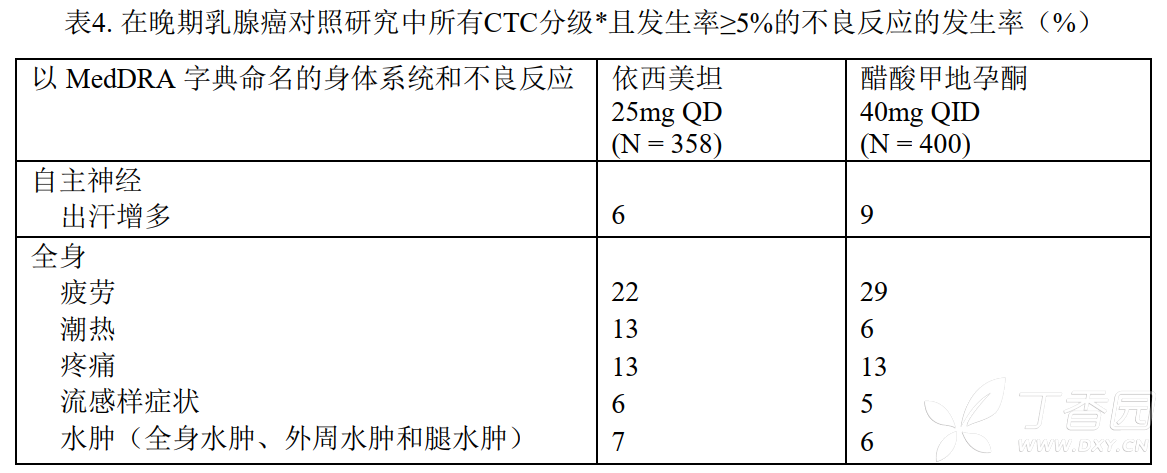
在该项对照研究中,接受依西美坦25mg/天治疗的患者中,任何原因引起的较少发生的不良反应(发生率2%-5%)有发热、全身无力、感觉异常、病理性骨折、支气管炎、鼻窦炎、皮疹、瘙痒、尿路感染和淋巴水肿。
在全部临床研究中(N=1058),接受依西美坦25mg/天治疗的患者(除对照研究外)中观察到的任何原因引起的发生率≥5%的其它不良反应有肿瘤局部疼痛(8%)、乏力(6%)和发热(5%)。上述临床研究的患者中,任何原因引起的发生率为2%-5%的不良反应有胸痛、感觉迟钝、意识模糊、消化不良、关节痛、背痛、骨骼痛、感染、上呼吸道感染、咽炎、鼻炎和脱发。
实验室异常:早期乳腺癌患者中依西美坦组血液学毒性(≥ CTC 1级)的发生率低于他莫昔芬组。
2组CTC3或4级不良反应的发生率都很低(大约0.1%)。在晚期乳腺癌的临床研究中,约20%接受依西美坦治疗的患者发生CTC 3或4级的淋巴细胞减少,其中有89%的患者在治疗前就有轻度的淋巴细胞减少,40%的患者在治疗后恢复或严重程度下降。未观察到病毒感染显著增加和机会性感染。在晚期乳腺癌患者的治疗中血浆AST、ALT、碱性磷酸酶和γ-谷氨酰转移酶水平大于正常范围上限的5倍(例如,≥CTC 3级)的报告罕见,但是大部分出现于有潜在肝和/或骨转移的患者中。
在晚期乳腺癌患者的对照研究中无肝转移情况下发生CTC3或4级γ-谷氨酰转移酶水平升高的发生率在依西美坦组为2.7%,醋酸甲地孕酮组为1.8%。
在早期乳腺癌患者中,依西美坦组比他莫昔芬组或安慰剂组更易发生胆红素、碱性磷酸酶和肌酐水平的升高。在IES研究中与治疗相关的胆红素水平的升高(任何CTC等级)的发生率,依西美坦组为5.3%,他莫昔芬组为0.8%;在027研究中依西美坦组为6.9%,安慰剂组没有发生。
CTC3或4级的胆红素水平升高的发生率,依西美坦组为0.9%,他莫昔芬组为0.1%。任何CTC等级的碱性磷酸酶水平升高的发生率,在IES研究中依西美坦组为15.0%,他莫昔芬组为2.6%;在027研究中依西美坦组为13.7%,安慰剂组为6.9%。肌酐水平升高的发生率,在IES研究中,依西美坦组为5.8%,他莫昔芬组为4.3%;在027研究中依西美坦组为5.5%,安慰剂组没有发生。依西美坦组观察到与治疗时间相关的骨密度下降。从基线到治疗24个月骨密度的改变见表5。试验中不允许伴随使用双膦酸盐、补充维生素 D 和钙。
表 5. 从基线到治疗 24 个月骨密度的改变(%),依西美坦组 vs 对照组1

药物/实验室检查相互作用:在临床实验室检查的结果中未观察到临床相关的改变。
上市后经验
免疫系统异常
少见: 超敏反应
神经系统异常
常见: 感觉错乱
肝胆系统异常
罕见: 肝炎, 淤胆型肝炎
由于不良反应来自不确定人群的自发报告, 故经常无法正确评估其发生频度或确定与药物之间的因果关系。
皮肤和皮下组织异常
常见: 荨麻疹,皮肤瘙痒
罕见: 急性全身发疹性脓疱病
运动员慎用。
本品不适用于内分泌状态为绝经前的女性。因此,如临床允许,应进行LH、FSH和雌二醇水平的检测以确定是否处于绝经后状态。也不应与含有雌激素的药物联合使用,此类药物将影响其药理作用。
有肝功能或肾功能损害的患者应慎用。
依西美坦片剂含有蔗糖,对于罕见糖耐量异常,葡萄糖-半乳糖吸收障碍或蔗糖酶-异麦芽糖酶不足的遗传性疾病的患者,不应使用。
依西美坦片剂含有甲基-磷酸化羟基苯,该成份可引起过敏反应(可能表现为迟发性)。
由于本品是强降低雌激素的药物,治疗后已观察到骨密度降低和增加的骨折率(见【临床试验】)。依西美坦用于辅助治疗时,患有骨质疏松症或有骨质疏松风险的女性在治疗开始时应采用骨密度测量法对骨矿物质密度进行正规检查。监测患者的骨密度损失,并在需要时进行治疗。
因为早期乳腺癌妇女中相关的维生素D严重缺乏极其普遍,应该在开始芳香酶抑制剂治疗前考虑进行25羟基维生素D水平的例行评估。维生素D缺乏的妇女应接受维生素D补充剂。
绝经前妇女用药
本品不适用于治疗绝经前的乳腺癌患者。
胚胎-胎儿毒性
根据动物研究结果和作用机制,妊娠妇女服用本品后可能会给胎儿带来伤害。在动物生殖研究中,妊娠大鼠和兔子接受依西美坦后可增加流产和胚胎-胎儿毒性的发生率。应告知妊娠妇女本品对胎儿的潜在风险。应告知具有生殖能力的女性在接受本品治疗期间以及服用最后一剂药物后1个月内采用有效的避孕措施。
【对于驾驶和机械操作的影响】
有使用本品后发生困倦、嗜睡、乏力、头晕的报告。应提醒使用本品的患者,如果发生这些症状,其操作机器或驾车的体力和/或精神状态可能会受到影响。
尽管尚未对这种相互作用的临床意义进行评估,但是与已知对CYP3A4有诱导作用的药物,如:利福平、抗惊厥药[苯妥英、卡巴咪嗪、苯巴比妥等]及某些含有贯叶连翘提取物[St John’s Wort]的中草药制剂,合并用药时,可以显著减少依西美坦的暴露,可能会降低本品的疗效。因此建议同时接受细胞色素P-450(CYP) 3A4的强诱导剂的患者进行剂量调整(见【用法用量】和【药代动力学】)。
依西美坦应慎与通过CYP3A4代谢且治疗窗窄的药物联合使用。尚无本品与其他抗癌药物联合使用的临床经验。
不应将依西美坦与其他含雌激素的药物联合使用,这将会降低其药理作用。
【临床试验】 以下信息主要来自国外进行的临床试验。
早期乳腺癌的辅助治疗
IES 031是一项针对绝经后早期乳腺癌患者接受依西美坦(25 mg/天)对比他莫昔芬(20或30 mg/天)治疗的国际多中心随机双盲研究。在接受他莫昔芬辅助治疗2-3年后疾病无进展的患者,随机给予3-2年的依西美坦或他莫昔芬治疗,以完成共5年的内分泌治疗。 该研究的主要目的是评价无病生存期(DFS),即比较绝经后早期乳腺癌患者在接受他莫昔芬2-3年后序贯依西美坦与继续使用他莫昔芬完成5年内分泌治疗的疗效。无病生存期(DFS)定义为患者随机入组到出现乳腺癌局部或远处复发、对侧乳腺癌或任何原因死亡的时间。 该研究的次要目的是比较两组的总生存期和长期耐受性。
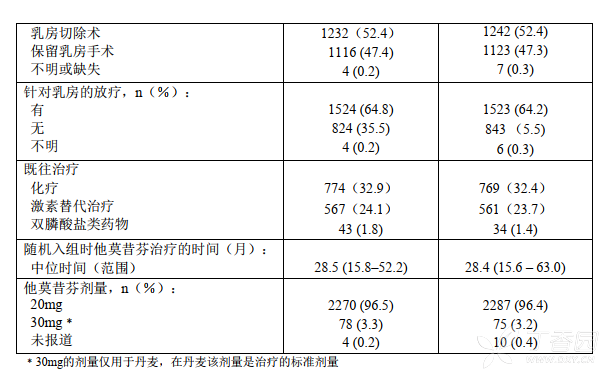
观察指标还包括出现对侧乳腺癌的时间和无远处复发时间。在意向性治疗分析(ITT)中,共有4724名患者在接受他莫昔芬2-3年后随机分为序贯依西美坦(25mg/天,N=2352)和继续接受他莫昔芬组(每天剂量与随机入组前相同,N=2372)。人口统计学特征和肿瘤基线特征见表6。既往乳腺癌治疗见表7。
表6.IES研究中绝经后早期乳腺癌患者的人口统计学特征和肿瘤基线特征(ITT人群)


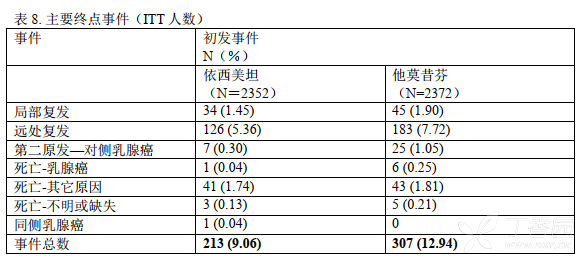
在 27 个月的中位治疗时间以及中位随访 34.5 个月后, 520 例事件被报道,其中依西美坦组有 213例,他莫昔芬组有 307 例(表 8)。
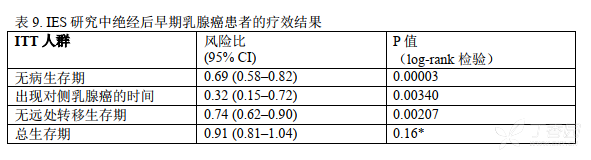
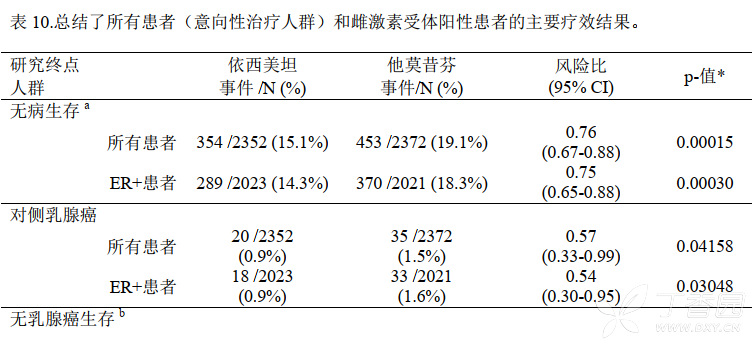
在意向性治疗(ITT)人群中依西美坦组和他莫昔芬组相比,前者的无病生存期得到显著改善「风险比(HR)=0.69, 95% CI: 0.58, 0.82, P = 0.00003,见表 9,图 1」。 对激素受体阳性的亚组(大约占所有患者的 85%)分析显示与他莫昔芬组相比依西美坦组中患者的无病生存期也得到显著的改善((HR = 0.65, 95% CI: 0.53, 0.79, P = 0.00001)。在淋巴结阴性或阳性的亚组患者和接受或未接受化疗的亚组患者中也观察到了一致的结果。在 119 个月中位随访时, 总生存期更新显示,两组之间的总生存期不存在显著性差异, 依西美坦组中有 467 例(19.9%)患者死亡, 他莫昔芬组中有 510 例(21.5%)患者死亡。
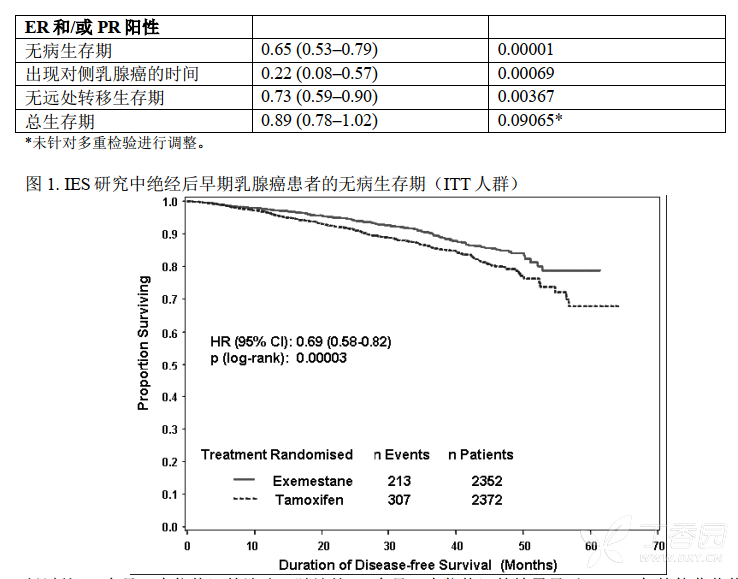
经过约 30 个月(中位值) 的治疗,随访约 52 个月(中位值)的结果显示: 2-3 年的他莫昔芬辅助治疗后序贯应用依西美坦的患者与持续接受他莫昔芬辅助治疗的患者相比,序贯应用依西美坦的患者的无病生存率(DFS) 提高,具有临床和统计学意义。分析显示与他莫昔芬相比,在研究观察期依西美坦降低了 24%的乳腺癌复发风险(HR=0.76,p=0.00015)。 依西美坦相对于他莫昔芬的无病生存疗效获益更明显,与淋巴结情况或既往化疗无关。
依西美坦还显著降低了对侧乳腺癌发生的风险(HR =0.57,p=0.04158)。
在所有研究人群中,观察到依西美坦组(222 例死亡)比他莫昔芬组(262 例死亡) 的总生存有提高的趋势, HR 为 0.85(log-rank 检验: p=0.07362), 显示依西美坦组死亡风险降低了 15%。在对事先设定的预后因素(如雌激素受体状态,淋巴结状态,既往化疗,激素替代治疗药物的使用和双膦酸盐药物的使用)进行校正后, 观察到依西美坦组比他莫昔芬组死亡风险减低了 23%(HR 为0.77; Wald Chi square 检验: p=0.0069) ,具有统计学意义。
对雌激素受体阳性或受体状态不明患者进行的进一步亚组分析显示,未经调整的死亡 HR 为 0.83(log-rank 检验: p=0.04250),显示本品可降低 17%的死亡风险,具有临床和统计学意义。关于骨的亚组研究分析结果表明, 采用 2-3 年的他莫昔芬辅助治疗后序贯应用依西美坦治疗, 患者的骨密度出现中度降低。 在总分析中, 30 个月的治疗过程中依西美坦组新发骨折的比例高于他莫昔芬组(分别为 4.5%和 3.3%, p=0.038)。
一项关于子宫内膜的亚组分析结果表明,接受依西美坦治疗 2 年后患者的子宫内膜厚度平均减少了 33%, 而他莫昔芬组则无明显变化。 研究治疗开始时报告有子宫内膜增厚的患者,在采用依西美坦治疗后有 54%的患者得到了逆转(< 5 mm)。
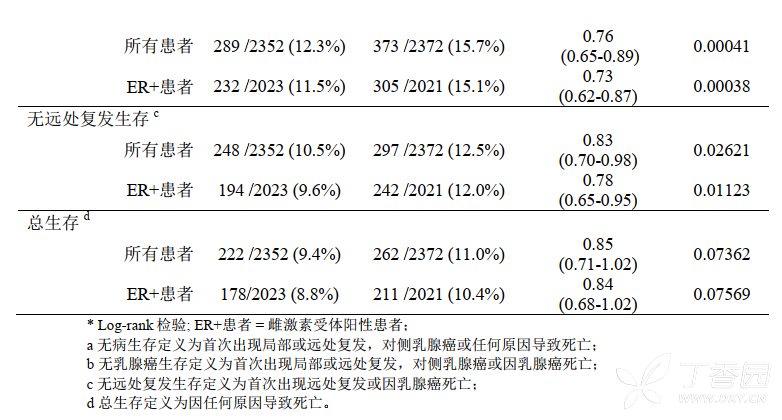
中位随访 87 个月在 30 个月的中位治疗期和 87 个月的中位随访期后的结果显示,相较于三苯氧胺连续治疗, 三苯氧胺辅助治疗 2 至 3 年后序贯应用依西美坦治疗与 DFS 具有临床和统计学显著改善相关。分析显示,在观察研究期间依西美坦较三苯氧胺降低了 16% 的乳腺癌复发风险 (HR 为 0.84, p = 0.002)。无论淋巴结状态或既往化疗状况如何, 依西美坦在 DFS 方面的获益效应均超过三苯氧胺。
依西美坦亦显著延长无乳腺癌生存期(HR 为 0.82, p = 0.00263), 以及无远处复发生存期(HR 为 0.85,p = 0.02425)。 依西美坦亦降低了对侧乳腺癌发生风险, 但是该效应不具有统计学意义(HR 为 0.74,p = 0.12983)。 在整体研究人群中, 与三苯氧胺 (420 例死亡) 相比,在依西美坦组(373 例死亡)中观察到有改善总生存期的趋势, HR 为 0.89 (log-rank 检验: p = 0.08972), 这意味着依西美坦可降低 11%死亡风险。 而在雌激素受体阳性或状态未知的亚组患者中,未校正的总生存 HR 为 0.86 (log-rank检验: p = 0.04262), 意味着降低了 14%死亡风险,具有临床和统计学意义。
在整体研究人群中, 根据预先设定的预后因素(即: 雌激素状态, 淋巴结状态, 既往化疗, 应用 HRT和应用双膦酸盐)进行校正时, 依西美坦较三苯氧胺可降低 18%的死亡风险,具有统计学意义 (总生存 HR 为 0.82; Wald Chi square 检验: p = 0.0082) 。与仅接受三苯氧胺治疗的患者相比, 依西美坦治疗患者的第二(非乳腺) 原发癌发生率较低 (5.6% vs.7.6%)。 (参考: 96-OEXE-031 临床研究方案概要)。
关于骨的亚组研究结果显示, 采用2-3年的三苯氧胺后序贯依西美坦 2 至3年在治疗期间增加了骨丢失 (依西美坦组, 36个月时BMD自基线百分比变化: -3.37 [脊柱], -2.96 [全髋部 ;以及三苯氧胺组: -1.29 [脊柱], -2.02 [全髋部])。但在随访期末, 治疗组之间BMD较基线改变的差异很小,但三苯氧胺组所有部位的 BMD最终降低幅度略微大些(依西美坦组, 治疗后24个月时BMD自基线百分比变化 -2.17 [脊柱], -3.06 [全髋部],以及三苯氧胺组: -3.44 [脊柱], -4.15 [全髋部])。
晚期乳腺癌的治疗
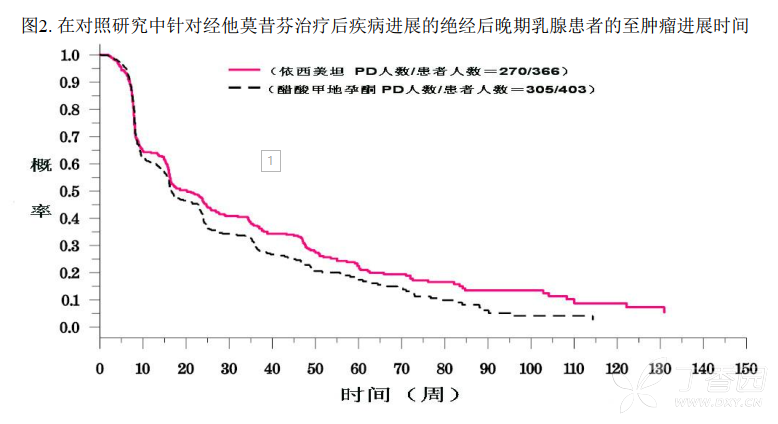
一项经同行审核的随机对照临床研究评价了依西美坦对晚期乳腺癌的疗效。试验比较了依西美坦(25mg/天)和标准甲地孕酮治疗经他莫昔芬辅助或一线治疗期间或之后出现疾病进展的绝经后晚期乳腺癌患者,结果表明依西美坦能延长生存期、 至肿瘤进展时间(TTP)、 至肿瘤治疗失败时间(TTF) 。
在一项国际多中心随机双盲研究及二项多中心单组研究中,经他莫昔芬针对转移病灶或辅助治疗后疾病仍有进展的绝经后晚期乳腺癌妇女,给予依西美坦(25mg/天)。一些患者既往接受过细胞毒药物作为辅助治疗或针对转移病灶的治疗。 这三项研究的主要目的是评价客观缓解率(完全缓解「CR」和部分缓解「PR」)。在对照研究中肿瘤进展时间和总生存期也作为评价指标。客观缓解率按照世界卫生组织(WHO)标准判定,在对照研究中提交到对患者治疗不知情的独立评审委员会评判。在对照研究中, 769例患者随机接受依西美坦25mg/天治疗(N=366)或醋酸甲地孕酮每日4次每次40mg治疗(N=403)。人口统计学特征和基线特征见表11

对照研究的治疗结果见表12。对照研究中, 依西美坦的客观缓解率与醋酸甲地孕酮组比较没有差异。在两项单组研究中, 依西美坦的缓解率分别为23.4%和28.1%.
表12. 在对照研究中针对经他莫昔芬治疗后疾病进展的绝经后晚期乳腺患者的疗效结果
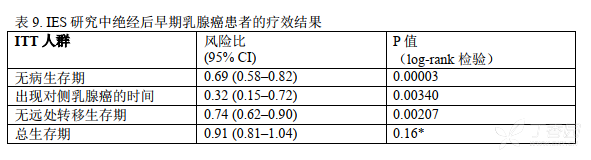
在治疗组中极少出现死亡病例,因此无总生存期差异。在对照研究中肿瘤进展时间的Kaplan-Meier 曲线见图2
毒理学研究:
大鼠和犬的重复给药的毒理学效应通常因依西美坦的药理学活性所致,如对生殖系统和附属器官产生的影响。其他毒理学效应(肝、肾或中枢神经系统)仅在明显超过人体最大暴露剂量时发生,一般认为无临床意义。
致突变性:
在体外细菌(Ames实验)和哺乳动物细胞(V79中国仓鼠肺细胞)中依西美坦无致突变作用。在体外没有代谢激活的情况下依西美坦对人类淋巴细胞有致畸变作用,但在体内(在小鼠骨髓中进行的微核实验)没有致畸变作用。在体外实验中依西美坦不增加大鼠肝细胞非常规DNA合成。
生殖毒性:
与人体系统暴露量(应用25mg/天的依西美坦)相似水平的依西美坦会导致大鼠或兔的胚胎毒性。无致畸性的证据。
致癌性:
雌性大鼠2年致癌性研究中,未观察到治疗相关的肿瘤发生。雄性大鼠研究中,由于慢性肾病导致的早期死亡,于第92周终止实验。小鼠两年的致癌性研究中,发现中、高剂量的依西美坦(150和450 mg/kg/天)在两种性别的小鼠均能增加肝脏肿瘤发生率。这一发现被认为与肝脏微粒体酶的诱导有关,微粒体酶的诱导只在小鼠体内而未在临床研究中发现。高剂量依西美坦(450mg/ kg/天)作用于小鼠还可引起雄性小鼠的肾小管腺瘤,这一改变有种属和性别特异性,且在小鼠药物剂量比人治疗剂量高63倍时才发生。在临床上,未观察到和依西美坦治疗有关的上述效应。